L’épidémiologie du virus de la fièvre catarrhale ovine (FCO, ou Bluetongue (BTV) en Anglais) continue d’évoluer à travers l’Europe, avec de nouvelles épidémies signalées en 2024 : BTV-3 en France, en Espagne, en Autriche, en Italie et en Pologne ; BTV-12 aux Pays-Bas ; BTV-4 en Autriche et BTV-1 en Espagne. Dans ce contexte en constante évolution, des méthodes diagnostiques efficaces sont essentielles pour contrôler la maladie, méthodes qui doivent être adaptées à différents objectifs1.
D’une part, les méthodes permettant de détecter le pathogène—telles que la RT-qPCR ou l’isolement viral—sont particulièrement indiquées pour confirmer les cas cliniques, surveiller la propagation de la maladie et évaluer le statut des animaux avant leur déplacement. D’autre part, les techniques sérologiques comme les ELISA et les tests de neutralisation virale (VNT) sont principalement utilisées pour contrôler le statut FCO d’une population et mesurer l’étendue de la dissémination de la maladie. La vaccination demeure un pilier central de la gestion de la FCO dans les pays touchés, et le choix et l’application des outils diagnostiques dans ce contexte présentent plusieurs défis.

Fondamentaux sur le virus de la FCO
Le virus de la FCO appartient au genre Orbivirus, qui inclut également le virus de la maladie hémorragique épizootique (MHE). Il existe 36 sérotypes connus de FCO, dont 24 sont transmis par des vecteurs et sont à déclaration obligatoire. La structure du virus comprend :
- 7 Protéines Virales Structurales (VP1-VP7)
- 5 Protéines Non Structurales (NS1, NS2, NS3a/3b, NS4)
Une représentation schématique du virus de la FCO est fournie en Figure 1. La protéine VP7 est très conservée parmi les différents sérotypes. Elle détermine le sérogroupe, différentiant ainsi le virus de la FCO de celui de la MHE. Par ailleurs, la VP2 – et dans une moindre mesure la VP5 – induisent la production d’anticorps neutralisants, définissant le sérotype du virus.
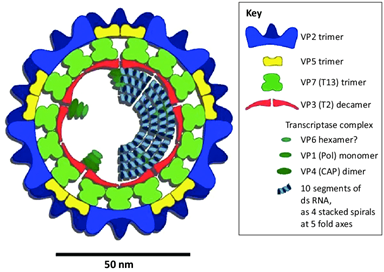
Outils diagnostics pour la FCO
Plusieurs techniques existent pour détecter les anticorps dirigés contre le virus de la FCO, notamment l’immunodiffusion en gélose (en Anglais AGID), la neutralisation virale (en Anglais VNT) et les tests ELISA (Enzyme-Linked Immunosorbent Assays). La méthode ELISA est fréquemment privilégiée en raison de sa simplicité, de l’objectivité de ses résultats (non liés à une interprétation subjective) et de sa capacité à traiter rapidement un grand nombre d’échantillons.
Pour la détection directe du virus, des méthodes telles que l’isolement viral et la RT-PCR—en particulier la RT-PCR en temps réel (RT-qPCR)—sont utilisées, cette dernière étant aujourd’hui la technique la plus répandue. De nombreux tests de RT-qPCR sont décrits dans le manuel de l’OMSA (en Anglais WOAH) et la littérature scientifique ou sont disponibles dans le commerce. Les tests ciblant les acides nucléiques des protéines non-structurales, comme le segment 10 codant pour la protéine NS3, peuvent détecter n’importe quel sérotype. A contrario, les tests ciblant le segment 2 (codant pour la protéine VP2) sont des outils fiables pour le sérotypage.
Les tests ELISA FCO sont-ils adaptés au suivi post-vaccination ? Comment faut-il interpréter les résultats ?
De nombreux vaccins contre la FCO sont inactivés et basés sur le virus entier. L’efficacité de ces vaccins dépend de la qualité de l’antigène et de son dosage. Des vaccins de haute qualité préviennent la virémie et l’apparition des signes cliniques. Selon le protocole de vaccination recommandé, une ou deux injections peuvent être nécessaires. Si la vaccination induit une forte réponse immunitaire par la production d’anticorps anti-VP2, le niveau d’anticorps anti-VP7 produit chez les animaux naïfs est généralement faible – souvent en dessous du seuil de détection des ELISA de compétition détectant les anti-VP7 – ce qui se traduit par des résultats négatifs ou faiblement positifs.
Comment évaluer le niveau de protection chez les animaux vaccinés ?
Le test de neutralisation virale (VNT) est la méthode privilégiée pour confirmer que les animaux vaccinés développent des anticorps neutralisants et protecteurs contre la protéine VP2 pour un sérotype donné. Les anticorps VP7 n’étant pas corrélés à la protection, la sérologie VP7 n’est pas recommandée pour le suivi post-vaccination ni pour l’évaluation de l’efficacité du vaccin. Le test ELISA VP7 ne peut pas être utilisé comme test DIVA (Différenciation des Animaux Infectés des Animaux Vaccinés), car des vaccinations répétées contre différents sérotypes, ou une infection naturelle par un autre sérotype chez des animaux vaccinés, peuvent conduire à des titres d’anticorps VP7 détectables, voire élevés.
Pourquoi l'utilisation d'un test ELISA basé sur la protéine VP2 constitue-t-elle un défi scientifique ?
Les réglementations européennes, dans le cadre de la nouvelle Loi de Santé Animale (LSA), exigent de prouver que les animaux sont protégés contre des sérotypes spécifiques. Le test de neutralisation virale (VNT) étant techniquement difficile à appliquer pour cet objectif, ne pourrait-on pas envisager comme alternative des tests ELISA de sérotypage basés sur la VP2 ? La réponse est non : les protéines VP2 de différents sérotypes de FCO partagent une forte homologie de séquence, entraînant une réactivité croisée importante entre les sérotypes. Cette réactivité croisée, déjà documentée pour la VNT (technique de référence)2,6, est encore plus prononcée en ELISA – en particulier pour les ELISA indirects. Par conséquent, les tests ELISA indirects basés sur la VP2 ne peuvent pas détecter les anticorps dirigés contre un sérotype spécifique, que ces anticorps résultent de la vaccination ou d’une infection naturelle. A ce jour et malgré de nombreuses tentatives, aucun test ELISA de sérotypage permettant d’obtenir des résultats fiables n’a pu être mis au point.
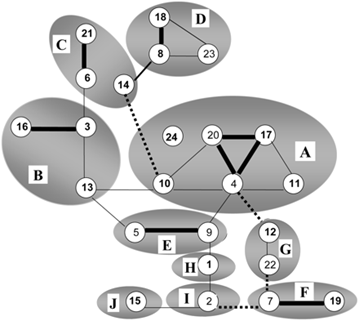
Sur la figure 2, les sérotypes de FCO apparentés, basés sur le segment 2 du génome exprimant la protéine d’enveloppe externe VP2 immunodominante spécifique du sérotype, sont regroupés par des cercles.
La neutralisation croisée entre les sérotypes de FCO est indiquée par des lignes ; neutralisation forte (épaisse), partielle (normale) et faible (en pointillés).
Dans ce contexte, comment prouver que les animaux sont protégés ?
Comme il est techniquement difficile, voire impossible, de prouver que les animaux sont protégés contre un sérotype spécifique (voir ci-dessus), les mesures suivantes sont généralement appliquées pour sécuriser les mouvements d’animaux :
- une preuve de vaccination avec un vaccin qui prévient la virémie ; dans certains cas, un résultat négatif par PCR est demandé si les animaux sont déplacés avant que la protection vaccinale soit pleinement établie ;
- la mise en œuvre de mesures sanitaires telles qu’un traitement insecticide des animaux pendant 15 jours, combiné à un résultat PCR négatif.
Les mesures mises en œuvre peuvent varier en fonction des réglementations locales.
La vaccination peut-elle impacter les résultats des tests de RT-qPCR ?
La vaccination avec des vaccins inactivés ne devrait pas entraîner de positivité en PCR, car aucune réplication virale n’a lieu. Dans de très rares cas, des valeurs de Ct tardives (par exemple, >38) peuvent être observées durant 6 à 10 jours après la vaccination1. En comparaison, les animaux naturellement infectés restent généralement virémiques pendant 30 à 45 jours en moyenne (avec de 0,001 % à 8 % des cas durant plus de 60 jours4), et l’ARN du virus de la FCO peut être détectable par PCR jusqu’à 6 à 7 mois5 après l’infection. Cependant, comme la vaccination a généralement lieu dans des régions où le virus circule, la positivité d’une RT-PCR après vaccination est très probablement due à une infection survenue peu de temps après la vaccination—avant que la protection immunitaire complète ne soit acquise. Par conséquent, il est essentiel d’analyser le statut vaccinal des animaux lors de l’interprétation des résultats de tests de RT-qPCR. Malgré ses limites pour déterminer le moment précis de l’infection, la PCR reste la seule méthode disponible pour détecter spécifiquement les différents sérotypes du virus de la FCO, et ainsi sécuriser les mouvements d’animaux à l’échelle mondiale.
Références
- WOAH Terrestrial Manual, Chapter 3.1.3. Bluetongue (infection with Bluetongue virus), B. Diagnostics techniques
- Bergh, C., Coetzee, P., & Venter, E. (2018). Reassortment of bluetongue virus vaccine serotypes in cattle. Journal of the South African Veterinary Association, 11, doi:10.4102/jsava.v89i0.1649
- Fay PC et al. (2021). Serological Cross-Reactions between Expressed VP2 Proteins from Different Bluetongue Virus Serotypes. Viruses, 13(8):1455, doi:10.3390/v13081455
- Estimations of the Infective Period for Bluetongue in Cattle, Report of the Scientific Committee on Animal Health and Animal Welfare, Sanco/B3/AH/R12/1999, European Commission Health & Consumer Protection Directorate-General
- Di Gialleonardo L, et al. (2011). The length of BTV-8 viraemia in cattle according to infection doses and diagnostic techniques. Research in Veterinary Science, 91(2):316-20, doi:10.1016/j.rvsc.2010.12.017
- Mann et al., J. Gen. Virol. (2007), 88, 621–630 (1990, adapted from Erasmus, 1990)
Texte traduit et adapté de l’article original publié en février 2025 sur : Boehringer Ingelheim Veterinary Public Health Scientific newsletter on Transboundary Animal Diseases.



 Retour
Retour